Benzen là gì? Benzen là một trong những hợp chất hữu cơ quan trọng và phổ biến trong lĩnh vực hóa học. Cấu trúc độc đáo của Benzen đã tạo nên một chỗ đứng quan trọng trong ngành công nghiệp hóa chất. Đây là một hợp chất không thể thiếu trong nhiều quá trình sản xuất và nghiên cứu. Nếu bạn đang làm việc trong ngành công nghiệp, hóa chất,.., bạn cần phải cẩn thận và hiểu rõ đặc tính của Benzen. Bởi vì ngoài công dụng làm nguyên liệu cho sản xuất, Benzen cũng gây ra những tác hại ảnh hưởng đến sức khỏe. Trong bài viết hôm nay, Eogas sẽ giới thiệu một loại hóa chất đã bị hạn chế sử dụng nhiều trong công nghiệp tại Việt Nam. Đó chính là benzen. Hãy cùng nhau khám phá benzen là gì nhé!
Xem thêm:
- Chất Khí là Gì
- Khí công nghiệp là gì? 5 loại khí công nghiệp phổ biến nhất
- Vai trò của Oxi đối với sự sống của con người
1. Benzen là gì?
Benzen là gì? Benzen là một chất hữu cơ có công thức hóa học là C6H6, có nghĩa là nó bao gồm sáu nguyên tử carbon (C) và sáu nguyên tử hydro (H). Trong điều kiện bình thường, Benzen là một chất lỏng không màu, mùi dịu ngọt dễ chịu, dễ cháy. Benzen ít tan trong nước nhưng dễ tan trong dầu khoáng, dầu động thực vật, dung môi hữu cơ,… đặc biệt là chất béo, sơn, vecni, hắc ín, cao su và nhựa đường, nhựa than,… Vì chỉ chứa carbon và hydro nên benzen là một hydrocarbon.

xr:d:DAEa_PHZxuA:853,j:2532555256035430372,t:23101806
Một số điều thú vị về Benzen:
- Benzen là thành phần tự nhiên của dầu thô và là một trong những hóa chất dầu cơ bản. Do các liên kết pi liên tục tuần hoàn giữa các nguyên tử carbon, benzen được phân loại là hydrocarbon thơm, [n] – annulen ([6] – annulen) thứ hai. Nó đôi khi được viết tắt là PhH.
- Mùi và Màu sắc: Benzen là một chất lỏng không màu với mùi ngọt dễ chịu. Nếu bạn từng ngửi mùi của một số hợp chất hóa học, mùi của Benzen có lẽ sẽ làm bạn ngạc nhiên vì nó khá dễ chịu.
- Tính Chất Vật Lý: Benzen dễ cháy, nghĩa là nó có thể bắt lửa dễ dàng. Nó tan kém trong nước và rượu, nghĩa là nếu bạn cố gắng trộn nó với nước hoặc rượu, nó sẽ không hòa quện tốt.
- Loại Hợp Chất: Benzen được gọi là hydrocarbon thơm. Từ “hydrocarbon” chỉ ra rằng nó chỉ chứa carbon và hydro, hai nguyên tử cơ bản trong hóa học.
Benzen có nhiều ứng dụng trong ngành công nghiệp, nhưng cũng cần phải sử dụng cẩn thận, vì nó có thể gây hại nếu không được xử lý đúng cách.
2. Công thức tổng quát và danh pháp của benzen
2.1. Đồng đẳng của Benzen là gì?
Dãy đồng đẳng của benzen (gồm benzen và ankylbenzen) có công thức chung là: CnH2n–6 (n ≥ 6). Công thức cấu tạo của dãy đồng đẳng này là dạng mạch vòng. Mỗi nguyên tử C dùng 3 obitan lai hóa để tạo liên kết σ với 2 nguyên tử C ở bên cạnh tạo liên kết với 11 nguyên tử H.
6 obitan p còn lại của 6 nguyên tử C tạo nên cấu trúc xen phủ bên với nhau tạo thành hệ liên hợp π chung cho cả vòng benzen đó. Vì vậy mà liên kết π ở benzen được cho là tương đối bền vững hơn so với liên kết π ở anken cũng như liên kết π ở các hidrocacbon không no khác.
Mô hình phân tử của benzen dạng đặc và rỗng như sau:

xr:d:DAEa_PHZxuA:854,j:7089072179735865380,t:23101806
Mô hình phân tử của benzen dạng rút gọn (hay còn gọi là dạng hóa học) như sau:

xr:d:DAEa_PHZxuA:855,j:695086606569994286,t:23101806
Chúng ta thường thấy 2 đồng đẳng của benzen là C7H8 ( Toluen ) và C8H10 (hay còn gọi là Xylen). Đây cũng là 2 hiđrocacbon thơm đứng đầu ( không tính benzen số 1) trong dãy đồng đẳng.

xr:d:DAEa_PHZxuA:856,j:8502076561086520878,t:23101806

xr:d:DAEa_PHZxuA:857,j:7755604924834410895,t:23101806
2.2. Đồng phân của benzen là gì?
Benzen (C6H6) là chất duy nhất trong dãy đồng đẳng của nó không có đồng phân. Tuy nhiên, khi ta đi xa hơn trong dãy đồng đẳng này, hiện tượng đồng phân hóa trở nên phổ biến hơn:
C8H10 và Các Đồng Phân Của Nó: Từ công thức phân tử C8H10 trở đi, các hợp chất trong dãy đồng đẳng của Benzen tồn tại 2 dạng đồng phân chính:
- Đồng Phân Mạch Cacbon: Điều này liên quan đến sự sắp xếp khác nhau của chuỗi cacbon trong hợp chất. Chuỗi cacbon có thể sắp xếp thành các cấu trúc phân nhánh khác nhau.
- Đồng Phân về Vị Trí của Các Nhóm Ankyl Xung Quanh Vòng Benzen: Các nhóm ankyl có thể bám vào vòng Benzen ở các vị trí khác nhau, tạo ra các đồng phân về vị trí. Ví dụ, nhóm ankyl có thể gắn vào vị trí 1,2 (ortho-), 1,3 (meta-), hoặc 1,4 (para-) của vòng Benzen.

xr:d:DAEa_PHZxuA:858,j:198564749921817473,t:23101806
Sự tồn tại của các đồng phân này không chỉ là một vấn đề lý thú trong lý thuyết hóa học. Nó cũng có tác động đáng kể đến tính chất vật lý và hóa học của các hợp chất, cũng như ứng dụng của chúng trong ngành công nghiệp và y học.
2.3. Cách gọi tên, danh pháp của Benzen
Khi thay thế các nguyên tử hidro trong phân tử benzen C6H6 bằng các nhóm ankyl khác nhau, ta thu được các chất hữu cơ ankyl benzen khác nhau, có công thức chung là CnH2n-6 với điều kiện n ≥ 6, ví dụ như C6H5CH3, C6H5CH2CH2CH3, C6H5CH2CH3,…
Có 3 cách biểu diễn cấu tạo của benzen như sau:
.jpg)
Đặc điểm cấu tạo của benzen là gì?
Chúng ta có thể gọi Benzen bằng những tên khác bao gồm:
- Benzol: Tên này thường được sử dụng trong ngành công nghiệp.
- Cyclohexatriene: Tên này mô tả cấu trúc của Benzen như là một vòng gồm sáu nguyên tử carbon với ba liên kết kép.
Danh pháp IUPAC (International Union of Pure and Applied Chemistry) chính thức của benzen là “benzene”, và tên này được sử dụng rộng rãi trong hóa học.
Các nhóm ankyl đính vào vòng chính của Benzen sẽ được xem là mạch nhánh, hay còn được gọi là nhóm thế. Các ankyl benzen có đồng phân mạch cacbon và tên gọi của chúng được người ta gọi theo vị trí của các nguyên tử C của vòng bằng các kí hiệu bằng chữ cái o (ortho), m (meta), p (para) hoặc chữ số. Từ đó, ta có thể gọi theo tên vị trí: Tên Vị Trí – Tên Nhánh + Benzen
Benzen và các chất trong dãy đồng đẳng có 2 tên gọi thường được sử dụng là tên thông thường và tên thay thế.
- Tên thông thường của benzen là gì: C6H6 ( Benzen ), C7H8 ( 1 đồng phân là Toluen ), C8H10 (tùy thuộc công thức cấu tạo mà có o-xilen, m-xilen hoặc p-xilen ).
- Tên thay thế của benzen là gì: “tên của nhóm ankyl”+”Benzen”

xr:d:DAEa_PHZxuA:860,j:1909932606298813687,t:23101806
3. Tính chất vật lý của benzen
Benzen (C6H6) là chất lỏng không màu, nhẹ hơn nước và không tan trong nước. Benzen được dùng làm dung môi để hòa tan nhiều chất như: Dầu ăn, cao su, cồn, iot… và nhiều dung môi hữu cơ khác.
- Trạng thái: Benzen ở trạng thái lỏng trong điều kiện bình thường, có mùi thơm đặc trưng.
- Khối lượng riêng: 0,8786 kg/m3
- Khối lượng phân tử: 78,11 g/mol
- Benzen là chất độc và dễ cháy.
- Điểm sôi: Benzen có điểm sôi ở 80.1 °C (176.2 °F).
- Điểm nóng chảy: Điểm nóng chảy của benzen là 5.5 °C (41.9 °F).
- Mật độ: Mật độ của benzen ở 15 °C là khoảng 0.879 g/cm³.
- Màu sắc: Benzen là một chất lỏng trong suốt và không màu.
- Khả năng hòa tan: Benzen hòa tan tốt trong các dung môi hữu cơ nhưng chỉ hòa tan ít trong nước.
- Điện tích điện môi: Benzen có điện tích điện môi khoảng 2.28.
- Áp suất hơi: ở 20 °C, áp suất hơi của benzen là khoảng 75 mmHg.
- Nhiệt độ tự cháy: Benzen tự cháy ở khoảng 498 °C (928 °F).
- Chỉ số hấp thụ UV: Benzen hấp thụ UV trong khoảng 200-280 nm.
- Phân loại: Hydrocarbon, Hiđrôcacbon thơm
- Hòa Tan: Benzen có thể hòa tan trong một số chất như: Acid acetic, Aceton, Chloroform, Carbon tetrachloride, Diethyl ether

xr:d:DAEa_PHZxuA:861,j:1441558247765570116,t:23101806
4.2 Tính chất hóa học
Phản ứng thế

xr:d:DAEa_PHZxuA:862,j:695086608704141046,t:23101806
Benzen (C6H6) tác dụng với halogen nguyên chất (Br2, Cl2,..) trong điều kiện nhiệt độ thường, chất xúc tác là sắt (Fe).
PTHH: C6H6 + Br2 → C6H5Br + HBr
Phản ứng nitro hoá: Phản ứng giữa benzen với axit nitric đặc, có xúc tác là nhiệt độ và axit sunfuric đặc.
PTHH: C6H6+HO−NO2 →C6H5−NO2+H2O
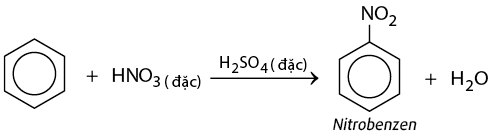
Minh họa phương trình phản ứng thế của benzen
Phản ứng cháy
Benzen(C6H6) cháy trong oxi (O2), ta thu được khí carbon dioxide (CO2) và hơi nước (H2O). Benzen cháy trong không khí sẽ tạo ra khí CO2, hơi nước và muội than.
PTHH: 2C6H6 + 15O2 (nhiệt độ) → 12CO2 + 6H2O
Phản ứng cộng
Benzen là gì? Benzen không có phản ứng cộng với Br2 như C2H4 và khí axetilen (C2H2). Tuy nhiên ở nhiệt độ và điều kiện xúc tác thích hợp, C6H6 tham gia phản ứng cộng với một số chất như khí hydro (H2) , …
PTHH: C6H6 + 3H2 (t, Ni) → C6H12
5. Phương pháp điều chế benzen
Cách 1: Đun nóng axetilen ở nhiệt độ 600 độ:
PTHH: C3CH=CH → C6H6
Cách 2: Dùng axit benzoic:
PTHH: C6H5COOH + NaOH → C6H6 + Na2CO3
Cách 3: Điều chế benzen là gì từ chưng cất nhựa than đá
Cách 4: Điều chế C6H6 từ xiclohexan sử dụng chất xúc tác là Pt và đun nóng:
PTHH: C6H12 → C6H6 + 3H2
Cách 5: Điều chế benzen từ n – hexan trong điều kiện xúc tác và đun nóng:
PTHH: C6H14 → C6H6 + 4H2
6. Ứng dụng của Benzen là gì?
- Trong ngành công nghiệp hóa hữu cơ, benzen được sử dụng để tổng hợp các monome trong sản xuất polyme, phục vụ cho việc sản xuất các loại chất dẻo, cao su, tơ sợi…..
- Dùng làm dung môi để hoà tan các chất như cao su, vecni, dầu mỡ,… và ứng dụng phổ biến trong tẩy rửa mỡ ở xương hoặc dầu mỡ trên bề mặt kim loại.
- Benzen là nguyên liệu điều chế ra nitroBenzen, anilin, phenol chuyên dùng để tổng hợp phẩm nhuộm, dược phẩm, thuốc trừ sâu,…
- Benzen đóng vai trò làm dung môi, sản xuất dược liệu trong y học, dược học.
- Benzen đóng vai trò làm dung môi trong công nghệ in ấn, chế bản, đồ họa.
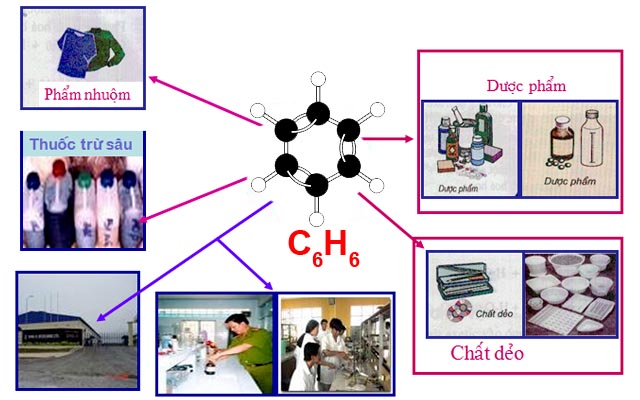
Ứng dụng của benzen (C6H6)
7. Khí benzen có độc không?
Benzen là một trong 20 loại hóa chất được sử dụng phổ biến nhất trong đời sống và nó cũng thuộc vào danh sách các chất có thể gây ung thư trên con người.
Nếu benzen dính vào da thì da sẽ bị khô, ngứa và sưng đỏ. Dính vào mắt sẽ khiến mắt đau rát, tổn thương giác mạc. Con người hít phải hoặc ăn uống thực phẩm có chứa Benzen ở nồng độ rất cao có thể dẫn đến tử vong.
7.1 Giai đoạn 1: nhiễm độc cấp tính
Hậu quả của nhiễm độc benzen là gì? Gây tổn thương da, mắt, hệ hô hấp với các triệu chứng như chóng mặt, đau đầu, buồn nôn,….
Tùy vào nồng độ benzen và thời gian tiếp xúc mà các triệu chứng có thể biểu hiện từ nhẹ tới nặng.
- Với hàm lượng benzen>65 mg/lít, nạn nhân sẽ rơi vào tình trạng hôn mê kèm co giật.
- Với hàm lượng khoảng 20-30 mg/l không khí, sẽ khiến nạn nhân mê man sau 20-30 phút.
- Với hàm lượng benzen > l0mg/l, nạn nhân thấy khó chịu, nhức đầu, chóng mặt, nôn sau vài giờ.
7.2 Giai đoạn 2: nhiễm độc mãn tính
Nếu tiếp xúc với benzen hoặc đồng đẳng benzen trong môi trường lao động với nồng độ vượt quá giới hạn cho phép, sẽ dẫn đến nhiễm độc mãn tính.
Biểu hiện của giai đoạn khởi phát: Rối loạn tiêu hóa, rối loạn thần kinh, rối loạn huyết học,..
Biểu hiện ở giai đoạn toàn phát: Ở thời kỳ này, bệnh được thể hiện qua hội chứng xuất huyết, thiếu máu, giảm bạch cầu.
Nhiễm độc benzen có nguy hiểm không?
Nhiễm độc benzen là một bệnh nguy hiểm. Ngay cả khi ngừng tiếp xúc, bệnh vẫn không loại trừ hết hoàn toàn vì lượng Benzen vẫn còn tích lũy ở các tổ chức nhiều mỡ, đặc biệt ở tủy xương.
7.3 Tại sao bị nhiễm độc benzen
- Bạn có thể nhiễm một lượng nhỏ benzen từ khói xe của các phương tiện giao thông hoặc khói thuốc lá (50% số người nhiễm Benzene là từ khói thuốc lá).
- Khi tiếp xúc với nguồn nước bị nhiễm độc do rò rỉ từ các bồn chứa xăng dầu ngầm dưới lòng đất hoặc từ các bãi rác thải độc hại.
- Khi tham gia sản xuất hoặc sử dụng Benzen trong thời gian dài. Điển hình như nhân viên ở các nhà máy lọc dầu, nhà máy sản xuất dược phẩm, lốp xe, hóa dầu, cây xăng, lính cứu hỏa, nhân viên phòng thí nghiệm…
- Thông qua đường tiêu hóa, hô hấp hoặc thẩm thấu qua da. Benzen là gì?



